山西医科大学第二医院麻醉科 山西太原 030001
【摘要】 目的 观察曲马多预先给药对急性心肌缺血大鼠心肌组织缺血区和非缺血区P物质(SP)表达的影响,探讨痛觉干预在缺血心肌保护中的作用机制。方法 健康成年雄性SD大鼠18只,体重270~300g,随机分为三组(n=6):假手术组(S组)、单纯冠状动脉结扎组(I组)和曲马多干预冠状动脉结扎组(T组)。S组大鼠开胸后在冠状动脉左前降支下穿线不结扎;I组大鼠开胸后结扎冠状动脉左前降支;T组大鼠经尾静脉注射曲马多12.5mg·kg-1,15min后结扎冠状动脉左前降支。各组在手术后计时3h。采用免疫组化、酶免疫试验和反转录-聚合酶链反应从蛋白和基因水平观察各组大鼠缺血区和非缺血区心肌SP的表达。 结果 I组大鼠缺血区与非缺血区心肌SP和SPmRNA的水平均较S组升高(P<0.05),T组低于I组(P<0.05),但仍高于S组(P<0.05)。 结论 曲马多预先给药可降低急性心肌缺血大鼠心肌组织SP的表达,提示曲马多痛觉干预可能参与缺血心肌的保护。
【关键词】 曲马多;预先给药;P物质;心肌缺血;大鼠
【Abstract】 Objective To investigate the effects of tramadol pretreatment on the expression of substance P(SP) in ischemic and non-ischemic myocardium following acute myocardial ischemia in the rats. Method Eighteen adult male Sprague-Dawley rats weighing 270 to 300 g were randomly divided into 3 groups(n=6, in each): Sham group(S)、Ischemia group(I) and Tramadol group(T). The left anterior descending branch of coronary artery was occluded(CAO)for 3 hours in Ischemia group and Tramadol group. In Tramadol group tramadol 12.5mg.kg-1 was injected through caudal vein 15min before CAO. The hearts were removed at the end of 3h myocardial ischemia for determination of SP protein content (by immuno-histochemistry and enzyme immunometric assay) and the expression of SPmRNA(by RT-PCR) in ischemic and non-ischemic myocardium. Results The SP and SPmRNA levels were increased significantly in ischemia group compared with sham group(P<0.05) and decreased markedly in tramadol group(P<0.05)in myocardium of ischemic and non-ischemic areas. Conclusions Tramadol pretreatment can significantly inhibit increase in SP expression in myocardium evoked by CAO, which might imply that tramadol pain-intervene might take part in cardioprotection against acute myocardial ischemia.
【Key words】 Tramadol; Pretreatment; Substance P; Myocardial ischemia; Rats.
急性缺血性心脏病是严重影响人类健康的疾患之一。传统观点认为:决定心肌缺血、心肌梗死的预后主要取决于心肌缺血的严重程度和持续时间、基础心功能状态、冠状动脉病变程度和心肌缺血的原因[1]。研究表明,急性心肌缺血可诱发大鼠整体心肌组织P物质(SP)表达的增高,提示神经源性机制可能参与心肌缺血的病理学过程[2]。本研究拟观察曲马多预先给药对急性心肌缺血大鼠心肌组织缺血区和非缺血区SP表达的影响,旨在探讨痛觉干预在缺血心肌保护中的作用机制。
1 材 料 与 方 法
1.1 主要试验材料及仪器
SP抗体、免疫组化及显色试剂盒(北京中山生物技术公司),SP EIA Kit(Cayman公司,美国),RNA抽提试剂盒(Qiagen公司,德国),Taq-DNA聚合酶、AMV反转录酶及PCR标准分子量(Promega公司,美国),曲马多(批号346G,Crunenthal公司,德国); Leica CM-1850 恒冷箱切片机(Leica公司,德国),IDA-2000数码显微图像分析系统(中国科学院北京空海科技发展有限公司), PTC-200型PCR仪(MJ公司,美国),GDS-8000紫外凝胶成像系统(UVP公司,英国),Bio-Red电泳仪(西安海拓普集团)。
1.2 实验动物分组及心肌缺血模型建立
健康成年雄性SD大鼠18只(山西医科大学动物中心提供),体重270~300g,随机分为三组(n=6):假手术组(S组)、单纯结扎冠状动脉组(I组)和曲马多干预冠状动脉结扎组(T组)。大鼠腹腔注射25%的乌拉坦1.2g·kg-1麻醉后固定于实验台,气管切开插管行人工机械通气(呼吸频率75次/min,潮气量8ml·kg-1),然后在左侧胸壁第3,4肋间旁开胸骨正中线1cm处沿肋间开胸,逐层钝性分离暴露心脏,切开心包,以左冠状静脉主干为标志,在左心耳下方2mm处进针,用6-0手术用无损伤线穿过心肌表层肌肉,在肺动脉圆锥旁出针,结扎冠状动脉左前降支(S组穿线不结扎冠状动脉,T组在结扎冠状动脉左前降支前15min经尾静脉注射人临床使用剂量6.25倍的曲马多12.5mg·kg-1)后计时3h。结扎后心肌变为暗红色,心肌收缩减弱,证明结扎成功,逐层关胸,并行负压引流胸腔。大鼠脱离呼吸机后即刻恢复自主呼吸[3]。冠状动脉左前降支结扎成功的标准为:左心室前壁局部发绀和活动减弱,并经主动脉染料(Chicago Blue)灌注出现未填充红色缺血区(图1)。
1.3 SP蛋白水平的免疫组化检测
各组动物在预定时间点开胸快速取动物心脏置于4%多聚甲醛—30%蔗糖混和液(PH7.4)中固定3h(4℃),OCT包埋,用Leica恒冷箱切片机做5µm厚连续冠状冰冻切片。采用链菌素亲生物素-过氧化酶连接法(SP法)进行免疫组织化学染色、AEC显色。每组大鼠随机观察缺血区和非缺血区各60个高倍视野(40×),使用BX51型Olympus显微镜结合IDA-2000数码显微图像分析系统进行SP蛋白水平的平均光度和阳性单位半定量分析。
1.4 SP蛋白水平的酶免疫法检测
取各组缺血区和非缺血区心肌(缺血区的对侧半球心肌组织)以及假手术组(穿线区和穿线区的对侧半球)心肌组织各100mg分置于1.5ml EP管中,加入2N醋酸后在电热恒温水浴箱95℃加热20秒,用JY92-2D超声波细胞粉碎机匀浆,匀浆液再置于水浴箱90℃加热10min,20000g 4℃离心20min,取上清液真空干燥后用EIA缓冲液1ml定溶。采用酶免疫法测定SP浓度。
1.5 SP基因表达的RT-PCR法检测
如上取各组缺血区和非缺血区心肌以及假手术组心肌组织各100mg分置于1.5ml EP管中。半定量RT-PCR采用β-actin为内参照,按Qiagen公司总RNA抽提试剂盒说明书提取总RNA,用紫外分光光度仪测定RNA浓度,琼脂糖电泳证实RNA完整性。逆转录反应在0.2ml EP管中进行,体系为:5×RT缓冲液6µl,RNA酶抑制剂(20/μl)0.5µl,dNTP(10mmol/L)2.5µl,AMV反转录酶(5/μl)0.8µl,随机引物(100pmol)5µl,DTT(0.01mol/L)1.5µl,RNA模板6µl,补充无RNA酶水至30µl。逆转录反应条件:42℃50min,98℃5min。逆转录反应结束后取5μl产物做PCR,cDNA的PCR引物序列(上海博亚生物技术公司设计合成)如下:SP(252bp),上游引物:5’-GAGCCCTTTGAGCATCTTCT-3’,下游引物:5’-ACGCCTTCTTTCGTAGTTCTG-3’;β-actin(422bp),上游引物:5’-GAGACCTTCAACACCCCAGCC-3’,下游引物:5’-TCGGGGCATCGGAACCGCTCA-3’。在25μl的PCR反应体系中包含MgCl21.5µl,dNTP(10mmol/L)1.5µl,Taq-DNA聚合酶(2/μl)1.0µl,上下游引物各1.5μl,缓冲液2.5μl,无RNA酶水10.5μl。扩增条件:95℃2min,94℃50s,50℃50s,72℃1min,共35个循环后于72℃终延伸10min。扩增完毕后取5µl PCR产物在溴化乙锭(EB)染色的1%的琼脂糖凝胶上电泳,采用GDS-8000紫外凝胶成像系统进行PCR产物条带扫描及半定量分析。计算目的基因与β-actin条带灰度的比值表示SPmRNA的表达水平。
1.6 统计学方法
计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 免疫组织化学结果
SP阳性免疫反应主要位于心内膜和心肌层的心肌细胞胞浆及心外膜血管内皮,缺血区心肌纤维排列紊乱,且可见大量中性白细胞浸润(图2)。 I组大鼠缺血区和非缺血区心肌SP平均光度和阳性单位的水平较S组升高(P<0.05),T组明显低于I组(P<0.05),但仍高于S组(P<0.05),见表1,2。
2.2 酶免疫法结果
I组大鼠缺血区和非缺血区心肌SP浓度均较S组升高(P<0.05),T组低于I组(P<0.05),但高于S组(P<0.05),见表1,2。
2.3 RT-PCR结果
S组心肌组织内有一定水平SPmRNA表达(图3)。I组大鼠缺血区和非缺血区心肌SPmRNA的表达较S组增强(P<0.05),T组低于I组(P<0.05),但高于S组(P<0.05),见表1,2。
3 讨 论
SP是广泛分布于中枢和外周神经系统具有众多生物活性的神经肽,主要在脊髓背根神经节合成后沿着神经元的中枢突和周围突双方向输送至末梢储存,受到各种刺激(物理、化学、生物)时逆行释放到局部组织中引起血管通透性增强,血浆蛋白外渗,导致神经源性炎症反应。外周组织器官内SP主要来源于器官内感觉神经末梢,但组织中淋巴细胞[4]、 嗜酸粒细胞[5]、肥大细胞[6] 和单核巨噬细胞[7] 也能合成并分泌SP。心肌缺血时感觉神经纤维受刺激后而通过轴突反射释放到局部心肌组织的SP可促进肥大细胞脱颗粒释放组胺、激肽、趋化因子、前列腺素、白三烯、IL-1、6、8、IFN-γ等大量炎症介质,可促进单核细胞分泌IL-1、IL-6、TNF-α等炎症因子[8],可延缓中性粒细胞凋亡[9],促进中性粒细胞黏附和移行[10],促进内皮细胞产生黏附分子[11]等等,形成瀑布式炎症反应,最终可能使心肌炎症从局部缺血区通过神经机制的介导影响到非缺血区即整体心肌。
痛觉干预是急性心肌梗死治疗中的一项措施,它可通过降低交感神经的过度活动而减轻患者的疼痛和烦躁,削弱神经内分泌压力反应,减少心肌耗氧量。本研究显示,结扎大鼠冠状动脉左前降支3h,大鼠缺血区和非缺血区心肌SP和SPmRNA的水平明显增加,曲马多干预后均显著下降。其机制可能有: (1)阿片受体表达于感觉神经元,在脊髓背根神经节合成后通过轴浆运输至感觉神经末梢[12]。外周组织发生炎症后诱导神经细胞轴突内阿片类受体的轴浆转运增强,周围感觉神经末梢阿片受体的数量上调[13]。曲马多与感觉神经末梢的μ1-阿片受体结合后降低心肌感受器对伤害性刺激的敏感性,减少内脏交感传入纤维向中枢传递伤害性刺激以及通过轴突反射引起SP释放,即减少神经源性促炎性因子来源;(2)曲马多可能直接作用于心肌组织内的免疫炎性细胞使SP的释放减少,即减少了免疫源性促炎性因子来源;(3)曲马多可能作用于脊髓背根神经节细胞的阿片受体使SP的表达下调;(4)曲马多还可能通过抑制神经元突触对去甲肾上腺素和5-羟色胺的再摄取,提高其在神经元外水平,激活下行单胺能递质系统的脊髓抑制通路而发挥作用。但其更为确切的作用机制有待进一步研究。
综上所述,曲马多预先给药可明显抑制急性心肌缺血大鼠心肌组织缺血区和非缺血区SP的表达,提示曲马多预先给药痛觉干预可能参与缺血心肌的保护。
参考文献
1陈在嘉,徐义枢,孔华宇主编.临床冠心病学.第1版.北京:人民军医出版社,1994,269-271.
2张建文,郭政.结扎大鼠冠状动脉诱发心肌及背根神经节内P物质变化的研究.中国危重病急救医学,2006,18(4):201-205.
3姜宗来,胡海涛,凌凤东.大鼠冠状动脉的解剖观察.西安医学院学报,1982,3:698-704.
4Lai JP, Douglas SD, Ho WZ. Human lymphocytes express substance P and its receptor. Neuroimmunol, 1998, 86: 80-86.
5Metwali A, Blum AM, Ferraris L, et al. Eosinophils within the healthy or inflamed human intestine produce substance P and vasoactive intestinal peptide. Neuroimmunol, 1994, 52: 69-78.
6Toyoda M, Makino T, Kagoura M, et al. Immunolocalization of substance P in human skin mast cells. Arch Dermatol Res, 2000, 292: 418-421.
7Ho WZ, Lai JP, Zhu XH, et al. Human monocytes and macrophages express substance P and neurokinin-1 receptor. Immunol, 1997, 159: 5654-5660.
8Cuesta MC, Quintero L, Pons H, et al. Substance P and calcitonin gene-related peptide increase IL-1 beta, IL-6 and TNF alpha secretion from human peripheral blood mononuclear cells. Neurochem Int, 2002, 40: 301-306.
9Bockmann S, Seep J, Jonas L, et al. Delay of neutrophil apoptosis by the neuropeptide Substance P: involvement of caspase cascade. Peptides, 2001, 22:661-670.
10Kahler CM, Pischel A, Kaufmann G, et al. Influence of neuropeptides on neutrophil adhesion and transmigration through a lung fibroblast barrier in vitro. Exp Lung Res, 2001, 27:25-46.
11Lindsey KQ, Caughman SM, Olerud JE, et al. Neural regulation of endothelial cell-mediated inflammation. Investig Dermatol Symp Proc, 2000, 5:74-78.
12Pare M, Elde R, Mazurkiewicz JE, et al. The Meissner corpuscle revised: a multiafferented mechanoreceptor with nociceptor immunochemical properties. Neurosci, 2001, 21:7236-7246.
13Mousa SA, Zhang Q, Sitte N, et al. β-Endorphin containing memory-cells and μ-opioid receptors undergo site-directed transport into peripheral inflamed tissue. Neuroimmunol, 2001, 115:71-78.
附 表
附图
附图1:冠状动脉左前降支结扎成功的标准
Fig 1 The standard of success of occluding the left anterior descending branch of coronary artery

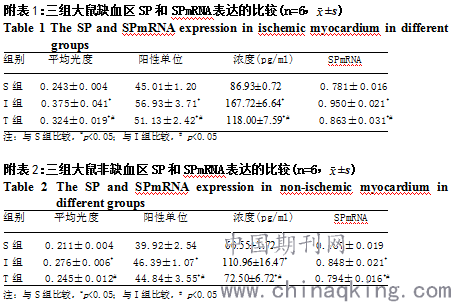
附图2: I组心肌组织内P物质表达的免疫组化染色结果 ×400
Fig2 Result of substance P immunohistochemistry in myocardium of rats in ischemia group ×400
注:SP在心肌组织的表达主要位于心内膜和心肌细胞胞浆及心外膜血管内皮,同时可见心肌组织内炎症细胞。DAB显色,苏木素复染,×400。
附图3: RT-PCR法检测SPmRNA在心肌组织内的表达
Fig3 RT-PCR detected SPmRNA expression in myocardium of rats in different groups
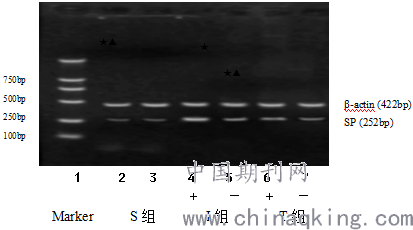
注:电泳图左侧第1泳道为marker;2、3泳道分别为S组冠状动脉左前降支血供区心肌和对侧心肌组织SPmRNA;4、5泳道分别为I组缺血区和非缺血区心肌SPmRNA;6、7泳道分别为T组缺血区和非缺血区心肌SPmRNA。+代表缺血区;—代表非缺血区。
论文作者:张建文 郭政
论文发表刊物:《临床医学教育》2017年12月
论文发表时间:2018/2/2
标签:心肌论文; 冠状动脉论文; 大鼠论文; 组织论文; 引物论文; 免疫论文; 阿片论文; 《临床医学教育》2017年12月论文;
