重庆医科大学 648800
【摘 要】目的:分析比较噻唑烷二酮类药物(thiazolidinediones,TZDs),包括罗格列酮和吡格列酮,与二甲双胍作为参照药物在治疗PCOS患者时的改善性激素及排卵率的疗效,探究TZDs治疗PCOS的优缺点,为临床治疗PCOS提供建议。方法:通过在PubMed、MEDLINE、Cochrane Library以及EMBASE数据库中检索关键词,收集比较TZDs和二甲双胍的疗效和安全性的随机对照研究。筛选符合纳入标准的文献进行研究。运用Cochrane协作工具对纳入文献进行质量评价和偏倚风险评估。利用Review Manager 5.0软件对相关数据进行Meta分析。结果:16篇文献纳入研究。TZDs在降LH水平、短疗程组的FT水平、升高长疗程组的DHEAS水平具有显著性(MD=-0.31、-0.39,0.35,P<0.05)。然而两种药物在提高排卵率、降低FSH(P=0.69)没有统计学差异。二甲双胍有更高的不良反应发生率。(RR=0.15,P<0.05)结论:TZDs在改善高雄激素血症和升高排卵率方面两者疗效相似。但TZDs使用期间不良反应发生明显少于二甲双胍,且该类药物服药方式简单,因此依从性更好。因而,在临床中,在降低高雄激素血症和增加排卵率疗效相当时,TZDs类药物因其更方便可优先考虑。
【关键词】多囊卵巢综合症;噻唑烷二酮类药物;二甲双胍;Meta分析
【中图分类号】R711.75【文献标识码】A【文章编号】2096-0867(2016)-2-008-05
背景
多囊卵巢综合症(Polycystic ovary syndrome ,PCOS)是一种包括循环雄激素升高,慢性排卵障碍,多囊卵巢等生殖问题的常见疾病[1],具有生殖和代谢异常特征,在育龄期女性中的发病率高达7-10%[2]。虽然PCOS的病理机制尚不明确,但已有许多证据表明胰岛素抵抗和高胰岛素血症是PCOS病理机制的重要因素[3、4]。胰岛素抵抗(Insulin resisitance,IR)会引起靶细胞不能对正常的胰岛素水平产生应答[5],继而代偿性增加胰岛素分泌,出现高胰岛素血症。在PCOS患者中,高胰岛素血症通常会降低性激素结合蛋白水平(sex hormone binding globulin,SHBG),进而导致游离雄激素进一步升高,这是高雄激素血症的重要机制[6]。
近年来,胰岛素增敏剂包括噻唑烷二酮和二甲双胍已用于改善胰岛素敏感性和卵巢功能。目前已有研究[7]表明噻唑烷二酮类药物可以改善PCOS患者的胰岛素敏感性和高胰岛素血症。但考虑到安全性因素,2013年美国内分泌学会提出的PCOS诊疗指南[8]中反对TZDs药物使用于PCOS患者,而且二甲双胍已经被推荐于在改善生活方式失败后且伴有2型糖尿病或糖耐量受损的PCOS患者[9]。目前,已有不少研究探讨了PCOS患者的排卵异常、多毛症、代谢紊乱等症状的病理机制,但在噻唑烷二酮和二甲双胍在治疗PCOS患者高雄激素血症方面仍有争议。一篇纳入了10篇随机对照试验的Meta分析[10]因为纳入文献异质性较高并没有证明TZDs在治疗PCOS患者中优于二甲双胍。
为了探究TZDs治疗高雄激素血症的疗效,需要更多的TZDs对比二甲双胍的治疗PCOS的大型临床对照试验。临床荟萃分析可以结合既往对比噻唑烷二酮和二甲双胍疗效的试验结果,以比较两者的疗效。
资料和方法
数据来源和收集
使用检索词检索国内外相关数据库:Pubmed、Medline数据库(从1966年至今)、EMBASE数据库(从1985年至今),以及Cochrane数据库中关于二甲双胍和噻唑烷二酮(包括吡格列酮、罗格列酮)治疗PCOS女性患者相关的随机对照试验(randomized controlled trial,RCT)。以下医学主题标题为检索关键词:“Polycystic Ovary Syndrome”“hyperandrogenism”“hyperinsulinemia”“euglycemic agent”“insulin enhance”“plasminogen activator inhibitor-I”“metformin”“biguanide,”“thiazolidinediones”“pioglitazone”“rosiglitazone”“human”“clinical trial and randomized controlled trial”。
文献的纳入和排除
根据纳入标准浏览摘要以筛选文献。纳入标准如下:
1.质量良好的随机对照试验,
2.研究对象为经1990年NIH诊断标准和2003年鹿特丹诊断标准确诊为PCOS的育龄期女性;
3.干预措施为以使用TZDs作为研究组和使用二甲双胍作为参照组,TZDs药物包括罗格列酮或噻唑烷二酮,疗程、剂量不限,但其他治疗方案两组必须相同(包括饮食、运动治疗等);
4.结局为排卵率、性激素指标、不良反应,仅纳入具有充足的相关数据的研究;
5.研究报告可提供OR(RR、率差、HR)及其95%可信区间,或可以转化为OR(RR、率差、HR)及其95%可信区间;若为计量资料应可提供均数,标准差和样本量等;
6.发表语言为英文;
排除标准如下:
1、同一研究人群的重复报告;
2、研究设计存在缺陷,缺乏随机分配等,质量差;
3、缺乏对照组或仅有自身前后对照;
4、组间基线明显不平衡,数据不完整、结局效应不明确;
5、统计方法错误且无法修正,无法提供或可供转化为OR(RR、率差、HR)及其95%可信区间,计量资料无法提供均数和标准差。
7.研究类型为综述、病例报告、摘要、信件和评论等。
出现重复性发表,只纳入质量更好或者样本量更大的文献。将符合标准的文献进行全文分析。
资料提取
从纳入文献中提取数据,计数资料记录具体数值,计量资料提取均值和标准误或标准差或95%CI。需要提取的资料信息包括如下:
(1)研究特征:随机方法、盲法情况、分配隐藏、随机患者数量、研究治疗持续时间,基线是否具有均衡性。
(2)患者特征: 平均年龄、研究纳入和排除标准、有无失访、失访率是否超过20%;若有失访,两组失访人数是否相同,是否采用ITT分析。
(3)干预措施:TZDs种类、TZDs和二甲双胍的剂量、使用疗程。
(4)结局指标:排卵率、游离睾酮(free testosterone,FT)、血清脱氢表雄酮(dehydroePiandrosterone,DHEAS)、卵泡刺激素(follicle-stimulating hormone,FSH)和促黄体激素(Luteinizing Hormone,LH)
(5)治疗相关的不良反应数量及类型。
由于噻唑烷二酮安全等级为C级,不适用于妊娠期妇女,妊娠率和活胎率未作为观察结局[9]。
纳入研究的偏倚风险评估
偏倚风险评估是根据考科兰系统评价手册(Cochrane Handbook for Systematic Reviews of Interventions)[12]推荐的方法进行。由两名研究员分别使用考科兰协作工具(The Cochrane Collaboration’s tool)[12]对随机对照试验进行偏倚风险评价。
统计学方法
采用STATA 12.0和Cochrane协作网提供的Review Manager 5.0软件对相关数据进行Meta分析。分类变量由Mantel-Haenszel法计算比值比以及95%可信区间;连续性变量采用倒方差法或Dersimonian-Laird法计算。进行效应量合并时,若每一种试验中使用同一种标准方法测量,则采用加权均数差(Weighted mean differences (WMD)表述;反之,使用标准化均数差(standardized mean differences (SMD)表述效应量。结果采用森林图展示其统计分析内容。当P>0.05 或95% 可信区间包含1.00 (RR) 或者 0 (WMD) 提示差异不具有统计学意义。
各临床试验的异质性采用Q检验,I2值的大小代表异质性的大小,若异质性检验差异无统计学意义(I2≤50%或P≥0.05)时,分析采用固定效应模型(Fixed effects model);当异质性检验有统计学意义(I2>50%或P<0.05)时,分析异质性原因,并用亚组分析、敏感性分析以及Meta-回归分析处理,对于无法消除异质性的文献采用随机效应模型(Randomized effects model)和描述性分析。亚组分析分为短程组(治疗持续时间少于6个月)和长程组(治疗持续时间大于等于6个月)。文献发表偏倚数据上分析应用Begg’s检验[13]和Egger’s检验[14]。并利用Review Manager5.0软件绘制漏斗图,若资料存在偏倚,会出现不对称的漏斗图。
结果
研究的纳入及一般特征
通过上述检索策略,在数据库中共检索出203篇相关文献,排除19篇综述、病例报告、队列研究等文献;浏览剩余185篇文献摘要,排除165篇不相关文献;按纳入标准筛选出符合前述条件的英文文献19篇,均针对全文仔细阅读。1篇因无可用数据而排除,1篇因未行单药治疗而排除;2篇文献因无对照组排除,还有1篇[15]因重复发表排除以及1篇文献未使用英文发表而排除。最终,14篇文献纳入到本研究,为2004-2013年发表的英文文献。检索流程可见于图1.0。
纳入文献的一般特征可见于表格1。14篇文献皆为TZDs(罗格列酮或吡格列酮)和二甲双胍单药治疗。本研究共纳入581名女性,其中使用TZDs的患者有271例,使用二甲双胍的有310例,所有的患者均为成年育龄期妇女。
各研究持续治疗时间从3个月到12个月不等。剂量方面,罗格列酮有4 mg/d、8 mg/d, 吡格列酮有30 mg/d、45 mg/d;二甲双胍每日服用1000 mg、1500 mg、1700 mg、2000mg和2550mg不等。
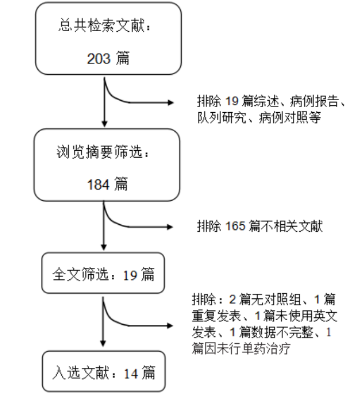
图1.0 检索流程
研究质量评价
本研究中,大部分文献的随机序列生成方法表述明确。只有4篇文献中的随机方法不明或有误。5篇研究因其适宜的隐藏方法,选择性偏倚处于低风险。另有5篇文献的方法学明确表述为盲法以及9篇文献提示结局指标评估者处于双盲状态。本研究中各文献的失访率在0%-44%。只有1篇文献进行了意向性分析(ITT,Intention-to-treat)分析。有3文献具有高失访率却未进行意向性分析。其中Baillargeon等的研究[20]由于两组失访率不均衡提高了偏倚风险。
除了3篇研究以外,其余文献的选择性偏倚处于低风险。有3篇文献由于TZDs对妊娠的影响提出建议患者在研究期间采取合理的避孕措施。有2项研究要求患者在试验前至少停用相关药物6个月。2篇研究[9][23]明确要求患者在试验前、中不改变每日能量摄入以及运动量。以上8篇文献减少了其他来源的偏倚风险。由于结局指标纳入研究较少,引起检验效能低以及难以判断漏斗图对称性,故不能利用Egger检验和Begg检验进行发表性偏倚分析和漏斗图绘[12]。
排卵率的改善
该指标纳入了4篇文献进行比较。异质性检验结果显示无统计学差异(I²%=34.05,P’=0.21),故采用固定效应模型分析。Meta分析结果显示两组排卵率疗效无显著性(P=0.58)。亚组分析后未改变显著性。森林图见图2.0。
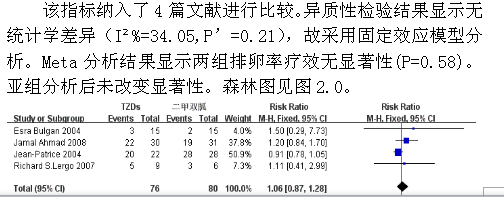
图2.0 TZDs与二甲双胍治疗PCOS的排卵率疗效比较
性激素相关指标
LH指标共纳入4篇RCT研究,异质性检验无统计学差异(P=0.55),采用固定效应模型进行合并分析,结果显示两组降低LH水平时具有显著性(MD=-0.31,P=0.03)。对FT、DHEAS、FSH指标进行异质性检验后结果有统计学差异。经亚组分析后,FSH异质性未降低,仅有DHEAS指标以及FT的短疗程组异质性降低,故采用固定效应模型合并分析,两组治疗FT短疗程组、DHEAS长疗程组有显著性(P=0.04、0.01)。为了探明FSH指标的异质性原因,对其进行敏感性分析,未发现异质性来源。FSH指标因纳入文献较少[26],不能进行Meta回归分析,行随机效应模型合并分析,提示两组疗效无统计学差异。FT、LH、DHEAS比较分析森林图分别见图2.1-2.3
.png)
图2.3 TZDs与二甲双胍治疗PCOS的DHEAS疗效比较
不良反应
在7项研究中发现了53例不良反应,通过异质性检验无统计学差异(I2=0%),两组的不良反应的发生率具有统计学意义 (RR = 0.16,P<0.05)。在二甲双胍组中,消化道反应最常见的不良反应,通常包括恶心、呕吐、腹泻等不适;但有1项研究[25]报告了恶心、腹泻的不良反应但未详细表示例数。在TZDs组中,有3例消化道不良反应发生[17],有2例中度头痛患者[24]。不良反应统计结果详见表3,森林图见图2.4
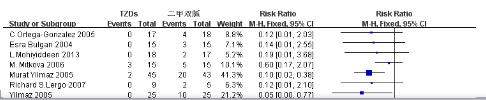
图2.4 TZDs与二甲双胍治疗PCOS发生的不良反应比较
讨论
在本临床荟萃研究中,共纳入了14篇文献,包括了581例PCOS患者,通过对排卵率、性激素指标的分析,比较了噻唑烷二酮和二甲双胍在治疗PCOS患者的部分疗效和安全性。研究结果表明,TZDs与二甲双胍在改善高雄激素血症及排卵率方面疗效相似,但TZDs不良反应发生率低于二甲双胍。
PCOS患者雄激素主要来源于卵巢[28]。Mitwally MF等[29]发现TZDs除了通过降胰岛素间接改善高雄激素血症,还可通过抑制细胞色素P45017-a和3β-羟化类固醇脱氢酶直接作用于卵巢以降低雄激素水平。Seto-Young等[30]试验说明TZDs还可以刺激孕酮和胰岛素样生长因子结合蛋白-1的分泌,抑制雌二醇和睾酮产生,增加卵巢胰岛素抑制因子的分泌,改善卵巢功能。在本研究中,TZDs在降低LH水平方面具有优势,在降低FSH、降低DHEAS、FT时两组总的疗效相当。根据DHEAS和FT的亚组分析结果可知,短疗程组中,TZDs改善FT优于二甲双胍,但在治疗超过6月后差异消失;在DHEAS指标的长疗程组中,TZDs弱于二甲双胍。但在X-J Li等研究中有不同的结果:TZDs在降低FT、DHEAS方面皆稍弱于二甲双胍。总的说来,TZDs与二甲双胍在改善高雄激素血症方面疗效相当。
本研究发现TZDs与二甲双胍在改善排卵疗效相当,这一点与X-J Li等[10]的结论一致。两种药物均可通过降低雄激素水平、改善卵巢功能从而提高排卵率以及提高怀孕率的作用,但也有研究不支持以上观点[31]。由于噻唑烷二酮类药物为安全等级C级药物,且部分研究要求患者在试验期间采取避孕措施或患者并无怀孕计划,难以观察怀孕结局。
已有文献报道噻唑烷二酮类药物的多种不良反应[32],例如肝毒性、水钠潴留、充血性心力衰竭等。罗格列酮曾因影响心血管安全性被严格限制使用,但2013年FDA专家小组再次审查了Record研究及其后续分析结果,最终解除了限制[33]。但又有文献[34, 35]提出吡格列酮可能会导致膀胱癌,欧洲Colhoun等[36]专家的一项大规模观察性研究结果表明吡格列酮每100天的累积用药不会增加膀胱癌风险。在本研究中,TZDs的不良反应以消化道反应、头痛、水肿为主,未出现骨折、心血管事件、心力衰竭等严重副反应发生。这可能与所纳入研究治疗时间和观察时间有限相关,期待更进一步的研究和观察。二甲双胍的不良反应更为常见,主要以恶心、呕吐、腹泻等消化道反应为主,故二甲双胍具有耐受性较差,副作用大等缺点,且其服药次数多为每日2或3次,患者依从性欠佳。总之,应用TZDs类药物治疗PCOS患者对比二甲双胍有更少的副作用及更好的耐受性和依从性。
总结
总之,根据本研究,TZDs在改善高雄激素血症和升高排卵率方面两者疗效相似,但TZDs在降低LH水平、短疗程降FT时优于二甲双胍。TZDs使用期间不良反应发生明显少于二甲双胍,而且服药方式更简单,依从性更好。因而,在临床中,在降低高雄激素血症和增加排卵率疗效相当时,TZDs类药物因其更方便可优先考虑。
局限性与展望
在本研究结果中有的文献方法学设计或描述不完善,且有部分指标因纳入文献偏少、样本量少等问题,异质性高,可信度低。这由于原始文献提供与异质性相关的数据有限,导致无从分析异质性来源。纳入文献的药物治疗剂量不一致,可能会影响结果。由于试验时间有限,缺乏长期远程的安全性指标以及妊娠远期结局。所以期待未来有更多噻唑烷二酮类药物与二甲双胍治疗PCOS相关的大样本、高质量的长期的随机对照试验。
参考文献
[1].Rouzi, A.A. and M.S. Ardawi, A randomized controlled trial of the efficacy of rosiglitazone and clomiphene citrate versus metformin and clomiphene citrate in women with clomiphene citrate-resistant polycystic ovary syndrome. Fertil Steril, 2006. 85(2): p. 428-35.
[2].Bajuk, S.K., S.M. Jensterle and M. Pfeifer, Cardiovascular risk and subclinical cardiovascular disease in polycystic ovary syndrome. Front Horm Res, 2013. 40: p. 64-82.
[3].Balen, A., Pathogenesis of polycystic ovary syndrome--the enigma unravels? Lancet, 1999. 354(9183): p. 966-7.
[4].Legro, R.S., Polycystic ovary syndrome: current and future treatment paradigms. Am J Obstet Gynecol, 1998. 179(6 Pt 2): p. S101-S108.
[5].Le Roith, D. and Y. Zick, Recent advances in our understanding of insulin action and insulin resistance. Diabetes Care, 2001. 24(3): p. 588-97.
[6].Nestler, J.E., et al., A direct effect of hyperinsulinemia on serum sex hormone-binding globulin levels in obese women with the polycystic ovary syndrome. J Clin Endocrinol Metab, 1991. 72(1): p. 83-9.
[7].Tang, T., et al., Insulin-sensitising drugs (metformin, rosiglitazone, pioglitazone, D-chiro-inositol) for women with polycystic ovary syndrome, oligo amenorrhoea and subfertility. Cochrane Database Syst Rev, 2012. 5: p. CD003053.
[8].Legro, R.S., et al., Diagnosis and treatment of polycystic ovary syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab, 2013. 98(12): p. 4565-92.
[9].Ortega-Gonzalez, C., et al., Responses of serum androgen and insulin resistance to metformin and pioglitazone in obese, insulin-resistant women with polycystic ovary syndrome. J Clin Endocrinol Metab, 2005. 90(3): p. 1360-5.
[10].Li, X.J., et al., Metformin vs thiazolidinediones for treatment of clinical, hormonal and metabolic characteristics of polycystic ovary syndrome: a meta-analysis. Clin Endocrinol (Oxf), 2011. 74(3): p. 332-9.
[11].Moher, D., et al., Improving the quality of reports of meta-analyses of randomised controlled trials: the QUOROM statement. Quality of Reporting of Meta-analyses. Lancet, 1999. 354(9193): p. 1896-900.
[12].Higgins, J. and S. Green, Cochrane Handbook for Systematic Reviews of Interventions. 2008, Wiley.
[13].Begg, C.B. and M. Mazumdar, Operating characteristics of a rank correlation test for publication bias. Biometrics, 1994. 50(4): p. 1088-101.
[14].Egger, M., et al., Bias in meta-analysis detected by a simple, graphical test. BMJ, 1997. 315(7109): p. 629-34.
[15].Jensterle, M., et al., Improvement of endothelial function with metformin and rosiglitazone treatment in women with polycystic ovary syndrome. Eur J Endocrinol, 2008. 159(4): p. 399-406.
[16].Cetinkalp, et al., The Effects of Rosiglitazone, Metformin, and Estradiol-Cyproterone Acetate on Lean Patients With Polycystic Ovary Syndrome. Endocrinologist, 2009. 3(19): p. 94-97.
[17].Mitkov, M., B. Pehlivanov and D. Terzieva, Metformin versus rosiglitazone in the treatment of polycystic ovary syndrome. Eur J Obstet Gynecol Reprod Biol, 2006. 126(1): p. 93-8.
[18].Ziaee, A., et al., Effect of metformin and pioglitazone treatment on cardiovascular risk profile in polycystic ovary syndrome. Acta Med Indones, 2012. 44(1): p. 16-22.
[19].Kilicdag, E.B., et al., Homocysteine levels in women with polycystic ovary syndrome treated with metformin versus rosiglitazone: a randomized study. Hum Reprod, 2005. 20(4): p. 894-9.
[20].Baillargeon, J.P., et al., Effects of metformin and rosiglitazone, alone and in combination, in nonobese women with polycystic ovary syndrome and normal indices of insulin sensitivity. Fertil Steril, 2004. 82(4): p. 893-902.
[21].Naka, K.K., et al., Effect of the insulin sensitizers metformin and pioglitazone on endothelial function in young women with polycystic ovary syndrome: a prospective randomized study. Fertil Steril, 2011. 95(1): p. 203-9.
[22].Mohiyiddeen, L., et al., Effects of low-dose metformin and rosiglitazone on biochemical, clinical, metabolic and biophysical outcomes in polycystic ovary syndrome. J Obstet Gynaecol, 2013. 33(2): p. 165-70.
[23].Cho, L.W., et al., Effect of metformin, orlistat and pioglitazone treatment on mean insulin resistance and its biological variability in polycystic ovary syndrome. Clin Endocrinol (Oxf), 2009. 70(2): p. 233-7.
[24].Yilmaz, M., et al., The effects of rosiglitazone and metformin on oxidative stress and homocysteine levels in lean patients with polycystic ovary syndrome. Hum Reprod, 2005. 20(12): p. 3333-40.
[25].Ahmad, J., et al., Comparison of metabolic effects of metformin and rosiglitazone in the management of polycystic ovary syndrome (PCOS): A prospective,parallel,randomized,open-label study. Diabetes&Metabolic Syndrome, 2008. 2(2): p. 37-46.
[26].Tian-song, Z., L. Jiang-bo and Z. Wen-zhao, Application of Stata in Exploring Sources of Heterogeneity: Meta-Regression Analysis. The Journal of Evidence-Based Medicine, 2009. 9(1).
[27].Du Q, et al., A systematic review and meta-analysis of randomized controlled trials comparing pioglitazone versus metformin in the treatment of polycystic ovary syndrome. Curr Med Res Opin, 2012. 28(5): p. 723-30.
[28].Lachelin, G.C., et al., Long term effects of nightly dexamethasone administration in patients with polycystic ovarian disease. J Clin Endocrinol Metab, 1982. 55(4): p. 768-73.
[29].Mitwally, M.F., S.F. Witchel and R.F. Casper, Troglitazone: a possible modulator of ovarian steroidogenesis. J Soc Gynecol Investig, 2002. 9(3): p. 163-7.
[30].Seto-Young, D., et al., Direct thiazolidinedione action in the human ovary: insulin-independent and insulin-sensitizing effects on steroidogenesis and insulin-like growth factor binding protein-1 production. J Clin Endocrinol Metab, 2005. 90(11): p. 6099-105.
[31].Legro, R.S., et al., Clomiphene, metformin, or both for infertility in the polycystic ovary syndrome. N Engl J Med, 2007. 356(6): p. 551-66.
[32].Costello, M.F., et al., Metformin versus oral contraceptive pill in polycystic ovary syndrome: a Cochrane review. Hum Reprod,2007. 22(5): p. 1200-9.
[33].Nissen, S.E. and K. Wolski, Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med, 2007. 356(24): p. 2457-71.
[34].Monami, M., I. Dicembrini and E. Mannucci, Thiazolidinediones and cancer: results of a meta-analysis of randomized clinical trials. Acta Diabetol, 2014. 51(1): p. 91-101.
[35].Bilezikian, J.P., et al., Rosiglitazone decreases bone mineral density and increases bone turnover in postmenopausal women with type 2 diabetes mellitus. J Clin Endocrinol Metab, 2013. 98(4): p. 1519-28.
[36].Lewis, J.D., et al., Pioglitazone Use and Risk of Bladder Cancer and Other Common Cancers in Persons With Diabetes. JAMA, 2015. 314(3): p. 265-77.
表1 纳入文献一般特征

.png)
论文作者:简逊,杨刚毅(通讯作者)
论文发表刊物:《系统医学》2016年第2期
论文发表时间:2016/4/12
标签:文献论文; 噻唑论文; 患者论文; 疗效论文; 胰岛素论文; 不良反应论文; 异质论文; 《系统医学》2016年第2期论文;
