1.蚌埠医学院公共课程部化学教研室 安徽蚌埠 233000 2. 四川大学化学工程学院 四川成都 610065
摘 要: 本文通过优化提取工艺条件,结合柱层析色谱及高效液相色谱法分离得到中草药金龙胆草中较纯的低极性组分,并运用FT-IR,NMR等波谱技术进行结构鉴定,发现其结构为α-菠甾醇。通过柱层析法和高效液相色谱法对低极性成分的分析探索,掌握中药有效成分提取、分离、鉴定的思路和方法,并为苦蒿的进一步药学研究提供资料。
关键词: 提取工艺,有效成分,色谱法
Abstract: In this paper, chromatography was used to analyze the low-polarity active ingredients in Conyza blinii levl. in the optimize condition of extraction procedure. α-spinasterol as a component of Chinese herbal medicine of Conyza blinii levl. was separated and purified by using column chromatography and HPLC. The molecular structure of α-spinasterol was identified by using spectrum technology such as: FT-IR, NMR, etc. The methods for analyzing the low polar components in Chinese herbal medicine was explored by column chromatography and HPLC, and the new approaches to extraction, separation, identification of effective components of Chinese medicine was mastered. Meanwhile, information for further pharmaceutical research of Conyza blinii levl. was provided.
Keywords: Extraction procedure; Active ingredients;Chromatography
金龙胆草(Conyza blinii levl.)为菊科白酒草属植物。白酒草属(Conyza)植物全世界约有80-100种,主要分布于东、西半球的热带和亚热带地区。我国有10种1变种,其中熊胆草(C. blinii )、木里白酒草(C. muliensis)和宿根白酒草(C. perensis)为我国特有种,仅在四川、云南和贵州等地有分布;小蓬草(C. canadensis)广布于我国南北各省区,其它种多分布于我国南部和西南部地区。本属植物除木里白酒草和宿根白酒草因资源局限,尚未见有药用记载外,其它种在国内或国外都有药用记载,主要用于各种炎症疾病的治疗。其中熊胆草及其制剂曾被中国药典1977年版收载,具有清热解毒、消炎祛痰、止咳平喘之功效,用于慢性气管炎、胃肠炎、肾炎、肝炎、痢疾、口腔炎、中耳炎、风火牙痛、湿疹、痔疮、外伤出血、烫火伤及牲畜创伤。
金龙胆草及其制剂在《中国药典》1997年版一部及《四川省药品标准》中收载[1]。药理试验证明其水煎液对肺炎双球菌,金黄色葡萄球菌,肺炎杆菌等菌种均有明显的抑制作用,亦具有明显的消炎止咳、祛痰、平喘等作用[2]。
金龙胆草中低极性化合物主要为挥发油和萜类及部分黄酮类[3]。其中萜类化合物是一类骨架庞杂、种类繁多、数量巨大、结构千变万化、又具有广泛生物活性的一类重要的天然药物化学成分。萜类化合物常常根据分子结构中异戊二烯单位的数目进行分类,如单萜、倍半萜、二萜等。萜类多数是含氧衍生物,所以萜类化合物又可以分为醇、醛、酮、羧酸、酯及苷等萜类。据不完全统计,萜类化合物超过22000种[4-7]。在天然药物化学成分的研究中,萜类成分的研究一直是较为活跃的领域,亦是寻找和发现天然药物生物活性成分的重要来源。金龙胆草所在的白酒草属植物所含二萜类化合物特别是半日花烷型二萜化合物种类较多。
本文主要通过柱层析法和高效液相色谱法对低极性部分的提取、分离鉴定进行探索。以便得到低极性成分,进而鉴定其结构。
1 实验部分
1.1 仪器及材料
奥泰高效液相色谱仪系统(426 HPLC Pump, UVIS 200 Detector, Evaporative light scattering detector (ELSD) 2000 ES, 530 Column Heater, Alltech, USA), N2000色谱工作站;核磁共振仪(NMR, Bruker BioSpin, Switzerland);Nicolet 6700傅里叶红外光谱分析仪(FT-IR, thermo scientific, USA);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);赛多利斯电子天平(Sartorius, 精度:0.0001g);二两装高速中药粉碎机(粉碎粒度200-300目,中国瑞安市环球药械厂);数显恒温水浴锅HH-2(国华电器有限公司);SHZ-D循环水式真空泵;真空干燥箱(河南巩义市英峪豫华仪器厂);旋转蒸发器(上海申胜生物技术有限公司);101-AB电热鼓风干燥箱(天津市泰斯特仪器有限公司);DBS-100电脑全自动部份收集器(上海沪西分析仪器厂有限公司)。
金龙胆草(采收于9月中旬,产地:四川省攀枝花市),甲醇(色谱纯),95%乙醇,二次蒸馏水(≥18 mΩ)。硅胶G(化学纯,青岛海洋化工有限公司),硅胶(柱层析用,粒度200-300目,青岛海洋化工有限公司),薄层板5 cm ×10 cm,层析柱20mm×300mm,玻璃点样毛细管:(内径:0.3mm,管长:100mm,华西医科大学仪器厂),三氟乙酸、羧甲基纤维素钠、石油醚、苯、氯仿、乙酸乙酯、丙酮等试剂均为分析纯。
硅胶G板的制备:配制羧甲基纤维素钠溶液:0.5 %,称取羧甲基纤维素钠5g,溶于1000mL蒸馏水中,加热煮沸直至完全溶解;选择5㎝×10㎝ 的层析板,用洗液浸泡,洗净,烘干,并用95%乙醇擦拭一遍;称取硅胶G 50.0g,放入研钵中,加入0.5%羧甲基纤维素钠150mL,研匀并调成稀糊状,均匀铺板,室温下凉干,于110℃活化1hr。然后放入有干燥剂的干燥器中待用。
1.2 提取工艺优化
称取10.0g粉碎的金龙胆草原药材于150mL圆底烧瓶中,加入氯仿60mL,振摇均匀,置于温度为60℃的水浴锅中回流提取1hr,转移提取液,采用同样的方法将残渣回流提取两次,合并三次的提取液,减压蒸馏浓缩,得深绿色粘性胶状提取物。分别改变浸提时间、回流温度、提取液用量设计如下正交试验(三因素三水平),其余操作条件同上。

提取工艺正交实验结果(图 1)显示:收率最高的条件为:T=80℃, C=6:1, t=3;收率最低的条件为:T=60℃, C=6:1, t=1。其它条件收率介于此二条件之间。随着温度的升高收率总体呈上升趋势,同样随着提取时间的增长收率也有升高的趋势。浸提时间为1hr时,收率与溶媒用量呈正比;为2hr和3hr时,收率与提取液用量呈反比。因此确定最佳提取条件为:T=80℃, C=6:1, h=2,收率6.0%。
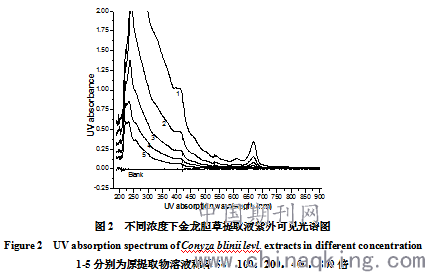
取粗提物用50%乙醇溶液溶解,稀释成不同浓度系列。通过紫外-可见分光光度计检测,发现粗提物成分复杂在200-425nm和660nm等处均有吸收,初步判断粗提物化学成分复杂。
2 结果与讨论
2.1 柱层析色谱法分离金龙胆草成分
2.1.1 柱层析分离条件选择
称取20.0g粉碎的金龙胆草原药材,根据以上最佳提取条件进行提取,真空干燥得1.19g粗提物,收率6.0%。
将粗提物用50mL丙酮溶解,溶液备用点样。通常进行柱色谱之前需要通过薄层色谱的方法寻找柱色谱的洗脱剂和用于馏分检查时的薄层色谱条件[8]。对低极性部分的洗脱系统常用的有:石油醚-乙酸乙酯、苯-丙酮、环己烷-丙酮等。参考文献中选出石油醚-乙酸乙酯[9]、苯-丙酮两个常用溶剂体系进行薄层实验(TLC),选出最佳洗脱体系。发现苯-丙酮极性跳跃适中且分离效果较好,故采用苯-丙酮体系进行柱层析分离。
同时选取不同体积配比的苯-丙酮进行TLC展开试验。由于氯仿萃取物中量大且成分复杂,各成分的极性差别较大,为使各成分得到较好的分离并且尽可能快速分离,实验中采用梯度展开。经TLC分析,确定了以下梯度:苯-丙酮(10:0, 8:2, 6:4, 4:6, 2:8, 0:10)。
2.1.2 柱层析色谱分离粗提物
称柱层析硅胶20.0g,用50mL苯溶解,超声10min,搅拌均匀,均匀加入柱中,底部剩余硅胶再加10mL苯溶解加入。总体积V0=60mL,死体积V1=26mL,保留体积Vrt=34mL。干法加样,将薄层实验用丙酮溶解的粗提物浓缩至约10mL,称1.5g硅胶,按上样中步骤加样。加样后用苯-丙酮梯度洗脱(10:0, 8:2, 6:4, 4:6, 2:8, 0:10),每个梯度用1倍量保留体积即34mL。共收集到26个馏分。
2.2 高效液相色谱法(HPLC)分析柱层析馏分
本实验采用的最优化色谱条件为:色谱柱采用Tiahhe Kromasil C18 column 100 A (5μm,250 mm×4. 6 mm) 反相色谱柱;UV检测器检测波长:250nm;蒸发光散射检测器:漂移管温度100℃,载气流速3L/min;流动相:V(水):V(甲醇)=50:50(含0.02 % TFA);流速:0.5 mL/min;柱温:30 ℃;进样量:20μL。图 2、3、4为样品硅胶柱层析后各馏分的高效液相色谱图。

由图 2A紫外检测器色谱图可以看出:Fr1-4几乎不含样品组分;Fr5-10对应的色谱图比较复杂,从6min到24min均有物质峰出现,且成分复杂,需要进一步分离纯化;Fr11-26只在6min左右有强吸收峰,且响应值明显高于前面各馏分值,可由此推测高极性组分最后被洗脱下来。同时也验证了随着硅胶柱洗脱剂极性的增强,弱极性组分先被洗脱出柱(如Fr5-10),强极性组分后被洗脱流出(如Fr11-26)。
图 2B蒸发光散射检测器色谱图可以看出:Fr1-6几乎不含样品组分;Fr7-21对应的色谱图较复杂。Fr7-10在10-20min有物质峰出现,为洗脱出的中低极性物质,但还需进一步分离纯化;Fr11-14在30min有一物质峰明显高于其他物质峰,而在紫外检测器中却无明显峰出现,知该物质极性低、结构简单,无共轭,仍需进一步分离纯化。Fr15-26含样品组分浓度较低,且成分复杂,仍需进一步纯化。
2.3 硅胶柱层析洗脱后各馏分处理
合并上述第一次柱层析馏分Fr6-9,浓缩后再经硅胶柱层析分离。分离条件为:20g硅胶(200-300目),柱高20㎝,直径2㎝。分别以石油醚-乙酸乙酯(8:2, 6:4, 4:6, 8:2,)、乙酸乙酯、甲醇为洗脱剂进行梯度洗脱。每个梯度用2倍量保留体积(60mL左右)。共收集32个馏分。

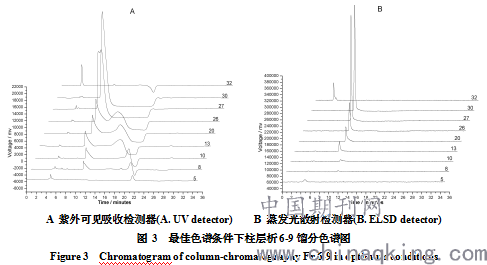
高效液相色谱分析第二次柱层析样品结果如图 3。图 3A紫外检测器色谱图可以看出:此HPLC图谱出现明显的倒峰为溶剂峰(因本检测样品所用溶剂为乙酸乙酯),暂不考虑。Fr1-7有效成分含量极低;Fr8-26所含成分几乎相同,主要在5min和10min左右有物质峰出现,但含量仍较低,且纯度不高;Fr27-30也在10min左右有明显物质峰,此峰面积占98%,纯度较高,浓缩后通过测定沸点、核磁、红外等确定物质结构;因弱极性组分先洗脱出柱,强极性组分后流出硅胶柱。Fr31-32在4min有物质峰,纯度较高,极性较大。
图 3B蒸发光散射检测器色谱图可以看出:与紫外检测的出峰情况相似,无溶剂峰出现,峰形很好。明显可得到紫外检测的结论,且Fr13-30在10min时的峰面积依次增大,即溶质含量逐渐升高,即此组分逐渐洗脱出柱。Fr30之后无该组分峰出现,但却在4min左右出现一极性很大组分色谱峰。
合并上述第一次柱层析馏分Fr15-26,浓缩后再经硅胶柱层析分离。分离条件为:20g硅胶(200-300目),柱高20㎝,直径2㎝。依次用石油醚、乙酸乙酯、甲醇洗脱,每个梯度用2倍量保留体积(60mL左右)。共收集7个馏分。
高效液相色谱分析第二次柱层析样品结果如图 4。图 4A紫外检测器色谱图可以看出:Fr1-2和6-7几乎不含有效成分;Fr3分别在6min和10min左右有物质峰出现;同时,图 4B蒸发光散射检测器色谱图可以看出:6min时几乎无响应值,10min对应有较高的吸收峰,为待鉴定样品成分吸收峰。Fr4-5仅在10min左右有物质峰出现,此峰面积占98%,纯度较高,浓缩后通过测定沸点、核磁、红外等确定物质结构。
如图 2AB馏分Fr12-13组分纯度高达98%(按HPLC峰面积计算)。合并馏分,真空干燥后即得样品X1。同样,得样品X2(Fr6-9过柱后,如图 3AB馏分31-32);X3(Fr15-26过柱后,如图 4AB馏分4-5)。分别取样品X1、X2、X3于核磁管中,进行1H-NMR分析。结果见图 5。再分别取X1、X2、X3与500mg干燥KBr混合压片,进行FT-IR光谱扫描得红外光谱图 6。



3 结论
综上所述,本实验通过优化提取条件,结合柱层析色谱及高效液相色谱法分离得到中草药金龙胆草中较纯的组分α-菠甾醇,并运用FT-IR,NMR等波谱技术鉴定其结构。本文为金龙胆草的进一步药学研究提供资料,并为中药有效成分提取、分离、鉴定提供有价值的思路和方法。
参考文献:
[1] 中华人民共和国药典 [S]. 一部: 2005.
[2] Mahato S B, Kundu A P. 13CNMR spectra of pentacyclic triterpenoids a compilation and some salient features [J]. Phytochemistry, 2015, 37(6): 1517-1575.
[3] Su Y, Koike K, Guo D. New apiose-containing triterpenoid saponins from Conyza blinii. [J]. Tetrahedron, 2016, 57(31): 6721-6726.
[4] Devon T K, Scott A I. Handbook of Naturally Occurring Compounds [M]. New York: Academic Press, 2014.
[5] Buttery R G, Maddox D M, Light D M, Ling L C. Volatile components of yellow starthistle [J]. Journal of agricultural and food chemistry, 2014, 34(5): 786-788.
[6] Connolly J D, Hill R A. Dictionary of Terpenoids [M]. London: CRC Press, 2015.
[7] Salvatore D R, Alfonso D G, Giuseppina T. Triterpenoids and sterol glucoside from cell cultures of Lycopersicon esculentum [J]. Phytochemistry, 2016, 44(5): 861-864.
[8] 罗洋, 柴欣, 吕敏. 金龙胆草化学成分及其抗溃疡活性研究(I) [J]. 中草药, 2017, 38(3): 332-334.
[9] 李嘉蓉. 天然药物化学实验 [M]. 北京: 人民卫生出版社, 2013.
论文作者:薛洪宝1,2 常华兰1 陶兆林1 梁丽丽1 李晖2
论文发表刊物:《临床医学教育》2018年7期
论文发表时间:2018/8/14
标签:层析论文; 色谱论文; 极性论文; 馏分论文; 组分论文; 乙酸乙酯论文; 硅胶论文; 《临床医学教育》2018年7期论文;
